人教版(2019)化学必修第一册《物质的量在化学方程式计算中的应用》金属材料PPT
展开
《物质的量在化学方程式计算中的应用》金属材料PPT
第一部分内容:目标与素养:
1.了解化学方程式中化学计量数与各化学计量间的关系。(模型认知)
2.掌握物质的量在化学方程式计算中的应用。(模型认知与科学精神)
... ... ...
物质的量在化学方程式计算中的应用PPT,第二部分内容:自主预习探新知
一、化学方程式中化学计量数与各化学计量间的关系
2Na + 2H2O===2NaOH+H2↑
质量之比: 46 g ∶ 36 g ∶ 80 g ∶ 2 g
计量数之比: 2 ∶ 2 ∶ 2 ∶ 1
扩大NA倍: 2NA ∶ 2NA ∶ 2NA ∶ NA
物质的量之比:2 mol ∶ 2 mol ∶ 2 mol ∶ 1 mol
结论:化学方程式中化学计量数之比等于______之比,也等于______之比,对于有气体参与的反应还等于______之比。
为什么利用化学方程式进行计算时,同一种物质的单位必须统一,而不同的物质则不必统一?
[提示] 同一种物质用不同的物理量表示时,比例是相同的。例如1 mol钠和23 g钠完全相同。
二、有关物质的量的计算中的“三个规范”
1.书写规范
各种符号的书写要规范,大写字母与小写字母的意义各不相同。如“M”表示________,而“m”表示________,“N”表示微粒数,而“n”表示________。
2.符号规范
(1)设未知数直接用各物理量的符号表示,且要注明物质(或粒子)的符号。如设参加反应HCl溶液的体积为V[HCl(aq)]。
(2)各物理量及单位、物质的名称、公式等尽量用符号表示。如已知NaOH溶液的体积和物质的量浓度,求NaOH溶液的质量时就写成:m(NaOH)=________________________________。
3.单位规范
把已知量代入计算式中计算时都要带单位且单位要统一。
... ... ...
物质的量在化学方程式计算中的应用PPT,第三部分内容:核心突破攻重难
物质的量在化学方程式计算中的方法
1.基本步骤
2.物质的量在化学方程式计算中应用的注意事项
(1)化学方程式中各物质的化学计量数之比等于各物质的物质的量之比,而非质量之比。
(2)计算时,各种物质不一定都用物质的量表示,也可以用质量表示,气态物质还可以用体积表示,但要注意物质的量与其他各物理量之间的换算关系;只要做到“上下一致,左右相当”即可。
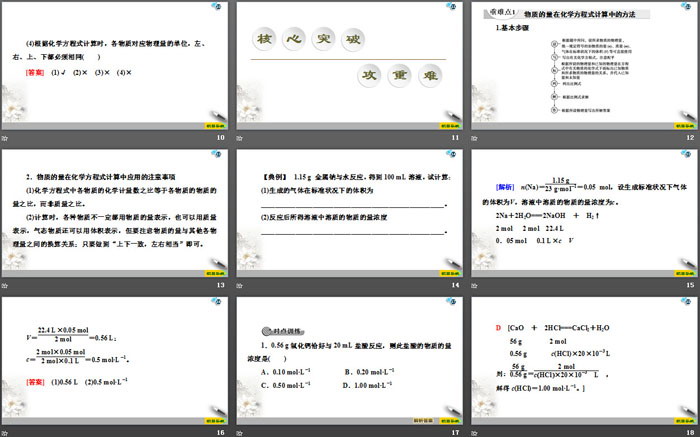
【典例】1.15 g 金属钠与水反应,得到100 mL溶液,试计算:
(1)生成的气体在标准状况下的体积为
_____________________________________________________。
(2)反应后所得溶液中溶质的物质的量浓度
_____________________________________________________。
1.0.56 g氧化钙恰好与20 mL盐酸反应,则此盐酸的物质的量浓度是( )
A.0.10 mol•L-1 B.0.20 mol•L-1
C.0.50 mol•L-1 D.1.00 mol•L-1
D [CaO + 2HCl===CaCl2+H2O
56 g 2 mol
0.56 g c(HCl)×20×10-3 L
则:56 g0.56 g=2 molcHCl×20×10-3 L ,
解得c(HCl)=1.00 mol•L-1。]
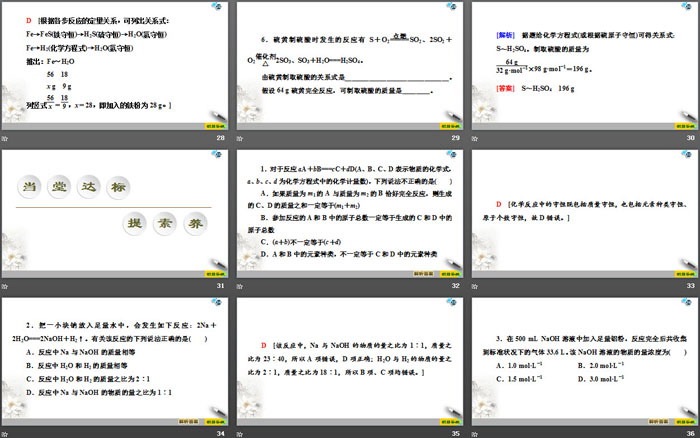
2.将1 mol Na和1 mol Al的混合物投入足量水中,产生的气体在标准状况下的体积为( )
A.11.2 L B.22.4 L
C.33.6 L D.44.8 L
D [根据化学方程式进行计算:
2Na+2H2O===2NaOH+H2↑
2 1
1 mol 0.5 mol
2Al + 2NaOH+2H2O===2NaAlO2+3H2↑
2 3
1 mol 1.5 mol
故Na、Al完全反应生成2 mol H2,在标准状况下的体积为44.8 L。]
化学计算中常用的方法
1.差量法——化学方程式计算中的巧思妙解
化学反应前后物质的量发生变化时均可用差量法。解题的一般步骤为
(1)准确写出有关反应的化学方程式。
(2)深入细致地分析题意,关键在于有针对性地找出产生差量的“对象”及“理论差量”。该“理论差量”可以是质量、物质的量、气体体积、压强等,且该差量的大小与参加反应的物质的有关量成正比。
(3)根据反应方程式,从“实际差量”寻找比例关系,列比例式求解。
2.关系式法——解答连续反应类型计算题的捷径
当已知量和未知量之间是靠多个反应来联系时,只需直接确定已知量和未知量之间的比例关系,即“关系式”。
(1)根据化学方程式确定关系式
写出发生反应的化学方程式,根据量的关系写出关系式。
(2)根据原子守恒确定关系式。
... ... ...
物质的量在化学方程式计算中的应用PPT,第四部分内容:当堂检测提素养
1.对于反应aA+bB===cC+dD(A、B、C、D表示物质的化学式,a、b、c、d为化学方程式中的化学计量数),下列说法不正确的是( )
A.如果质量为m1的A与质量为m2的B恰好完全反应,则生成的C、D的质量之和一定等于(m1+m2)
B.参加反应的A和B中的原子总数一定等于生成的C和D中的原子总数
C.(a+b)不一定等于(c+d)
D.A和B中的元素种类,不一定等于C和D中的元素种类
D [化学反应中的守恒既包括质量守恒,也包括元素种类守恒、原子个数守恒,故D错误。]
2.把一小块钠放入足量水中,会发生如下反应:2Na+2H2O===2NaOH+H2↑。有关该反应的下列说法正确的是( )
A.反应中Na与NaOH的质量相等
B.反应中H2O和H2的质量相等
C.反应中H2O和H2的质量之比为2∶1
D.反应中Na与NaOH的物质的量之比为1∶1
D [该反应中,Na与NaOH的物质的量之比为1∶1,质量之比为23∶40,所以A项错误,D项正确;H2O与H2的物质的量之比为2∶1,质量之比为18∶1,所以B项、C项均错误。]
3.在500 mL NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6 L。该NaOH溶液的物质的量浓度为( )
A.1.0 mol•L-1 B.2.0 mol•L-1
C.1.5 mol•L-1 D.3.0 mol•L-1
... ... ...
关键词:人教版高中化学必修一PPT课件免费下载,物质的量在化学方程式计算中的应用PPT下载,金属材料PPT下载,.PPT格式;